L’évaluation contestable de l’innovation pharma
Article publié dans Le Temps le 30 mars 2011.
L’affaire récente du Mediator en France rappelle que les risques réels des médicaments ne sont pas tous connus à l’avance. Ils sont à découvrir au fur et à mesure de leur utilisation par les médecins et leurs patients dans des conditions réelles au sein de la population. C’est en améliorant sans cesse les traitements existants que les laboratoires pharmaceutiques diminuent ces risques. Or, sous la pression de la «maîtrise» comptable des coûts de l’assurance-maladie, cette innovation graduelle se trouve menacée aux dépens des patients et de leur qualité de vie.
Quelle que soit la nature d’un nouveau produit ou service, son caractère novateur et le progrès qu’il représente sont normalement évalués directement sur le marché. C’est par un processus spontané et minutieux que l’innovation est valorisée par l’ensemble des consommateurs en fonction de leurs préférences. Si un nouveau produit ne représente pas de progrès, il n’est pas demandé et son fabricant est directement incité à en arrêter la production. Dans le domaine du médicament, cette logique a cependant été écartée par les pouvoirs publics. L’appréciation du progrès que représentent les nouveaux médicaments est ainsi confiée en France à un organisme bureaucratique peu médiatisé, la Commission de la transparence (CT).
Il existe ainsi une réelle déconnexion entre ceux qui évaluent les nouveaux traitements et ceux qui sont censés profiter de leurs bénéfices éventuels. Les patients conseillés par leurs médecins n’ont pas voix au chapitre.
Une telle déconnexion présente plusieurs dangers dans le contexte français où la «maîtrise » comptable des dépenses de santé reste une des priorités des pouvoirs publics.
Car cette «maîtrise» crée une forte pression à ne pas reconnaître les «petites» innovations réalisées sur des médicaments déjà existants. Bien réelles, elles sont néanmoins moins visibles et de ce fait leur évaluation est plus facilement manipulable que ne peut l’être celle de nouveaux traitements «pionniers» ouvrant de nouvelles classes thérapeutiques à l’image de la pénicilline.
Derrière un jargon bureaucratique propre à la CT, le stratagème en réalité est simple. Il s’agit d’attribuer des «notes» aux nouveaux traitements tout en excluant de la grille et des critères d’évaluation un certain nombre de paramètres.
La CT classe ainsi les nouveaux médicaments selon leur «amélioration du service médical rendu» (ASMR) dans cinq catégories, allant d’ASMR I («progrès thérapeutique majeur») à ASMR V («absence d’amélioration»).
En tant que patient, vous estimez sans doute importantes pour votre qualité de vie l’acceptabilité, la commodité d’emploi et d’observance d’un médicament – préférant par exemple un patch ou une prise orale à la place d’une injection effectuée en cabinet.
Votre médecin trouve probablement aussi utiles les compléments de gamme pour mieux vous traiter. Ces critères ont pourtant été exclus en 2004 de la grille d’évaluation en matière d’ASMR. Bien qu’innovant sous tous ces rapports, un médicament serait jugé comme non innovant et se verra donc quasi systématiquement attribuer une ASMR V.
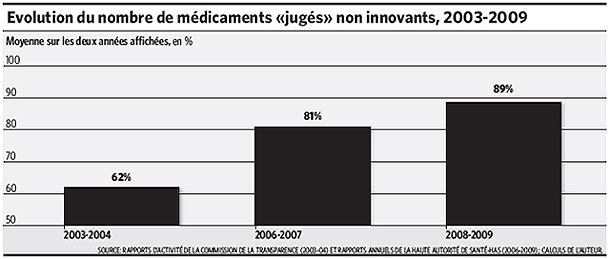
Bien qu’innovant sous tous ces rapports, un médicament risque toujours de se voir décerner la pire note. Le nombre de ces avis ASMR V a ainsi considérablement augmenté après 2004, passant en moyenne de 62% en 2003-2004 à 89% en 2008-2009, touchant donc près de 9 sur 10 des nouveaux produits examinés.
C’est comme si les pouvoirs publics – s’étant arrogé la prérogative d’évaluer l’innovation dans la téléphonie mobile – estimaient que les smartphones d’aujourd’hui, à l’image de l’iPhone, n’apportaient aucune «amélioration du service téléphonique reçu» par rapport à nos premiers modèles, pourtant bien plus lourds, moins commodes à utiliser et sans fonctionnalités annexes, prétextant que la qualité audible des appels serait similaire.
L’évaluation de la CT serait sans importance si l’attribution d’une mauvaise «note» (ASMR IV ou V) n’était pas sans conséquences pour la commercialisation du médicament en France et pour les patients. En effet, les avis de la CT conditionnent par la suite le prix de commercialisation établi par les pouvoirs publics, ainsi que le taux éventuel de remboursement par le régime d’assurance-maladie. Autant dire qu’ils revêtent une importance de premier ordre pour le sort de tout nouveau médicament en France.
Ainsi, par exemple, le médicament ne sera commercialisé que si son prix est inférieur au prix des traitements existants, même s’il s’agit de celui d’un générique fixé 10 ou 15 ans auparavant, sans indexation en fonction de l’inflation. Des baisses de prix imposées aux laboratoires par les pouvoirs publics peuvent ainsi être considérables, atteignant 75% du prix de référence, comme ce fut le cas d’un antalgique ayant reçu une ASMR V en 2006.
De telles pratiques de baisses légales «court-termistes » peuvent cependant entraîner une commercialisation retardée, voire même la non-commercialisation de certains médicaments en France, en dépit de leur disponibilité ailleurs. Des prix trop bas – qui ont suivi l’attribution d’ASMR défavorable par la CT – ont par exemple empêché la commercialisation de nouveaux traitements de la maladie de Parkinson, même si le traitement de référence datait des années 1960 avec des effets secondaires considérables.
Une telle politique n’est pas non plus sans danger à plus long terme pour l’innovation, risquant ainsi d’amputer artificiellement une partie des moyens des laboratoires qui assurent la R & D et les innovations majeures de demain. L’impact là encore sera indirectement sur le futur état de santé des malades, sans que ceux-ci aient le choix dans le système monopolistique d’assurance-maladie en France.
Valentin Petkantchin est chercheur associé à l’Institut économique Molinari.